
圖片來自 Journal of Clinical Investigation, 2024, doi:10.1172/JCI161660
這項新的研究著重關注于一種名為“過繼細胞轉移”的免疫療法,它涉及從病人體內提取T細胞,增強它們的抗癌能力,在培養基中擴增T細胞,并將它們重新注入病人體內。
在一項新的研究中,來自路德維格癌癥研究中心的研究人員開發出了一種新型免疫療法,它采用雙管齊下的方法來攻擊實體瘤,以增強免疫系統靶向和消滅癌細胞的能力。相關研究結果發表在Journal of Clinical Investigation期刊上,論文標題為“Combining SiRPα decoy–coengineered T cells and antibodies augments macrophage-mediated phagocytosis of tumor cells”。
這項新的研究著重關注于一種名為“過繼細胞轉移(adoptive cell transfer, ACT)”的免疫療法,它涉及從病人體內提取T細胞,增強它們的抗癌能力,在培養基中擴增T細胞,并將它們重新注入病人體內。
領導這項研究的路德維格癌癥研究中心研究員Melita Irving說:“雖然T細胞療法在治療某些血癌方面取得了巨大成功,但由于腫瘤微環境中的免疫抑制機制,對實體瘤的治療帶來了更復雜的挑戰。僅靠T細胞可能還不夠,這就是為什么我們正在探索通過整合其他免疫增強策略來提高T細胞有效性的方法。”
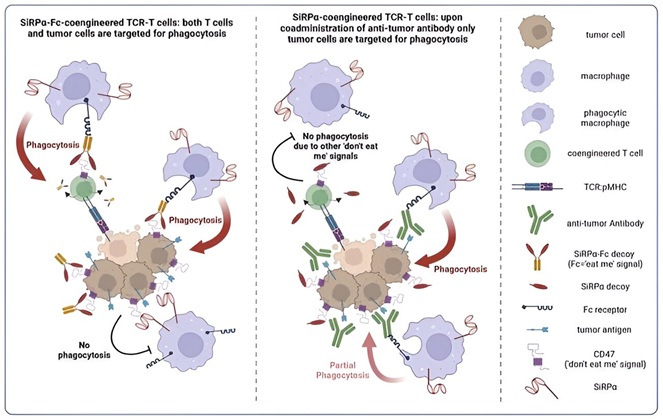
在這項新的研究中,Irving和她的團隊改造了T細胞,使其分泌CV1,即人類蛋白SiRPα的高親和力版本。
SiRPα通常與CD47相互作用,其中CD47是一種存在于健康細胞表面上的蛋白,它傳遞一種“別吃我”的信號,以防止巨噬細胞吞噬它們。然而,許多癌細胞利用這一系統,過度表達CD47,以避免被吞噬。
Irving解釋說:“先天性免疫系統,尤其是可以吞噬腫瘤細胞的巨噬細胞,對我們抗擊癌癥的免疫防御至關重要。”(T細胞屬于免疫系統的另一個分支,即適應性免疫系統)。
Irving團隊之前開發的CV1誘餌能以高親和力結合CD47,有效抑制這種“別吃我”的信號。據預計這將提高對癌細胞的可識別性,使其更容易受到巨噬細胞的攻擊,與此同時,癌細胞也會成為這些經過改造的T細胞的攻擊目標;這些經過改造的T細胞除了分泌CV1之外,還會表達親和力優化的T細胞受體(TCR)。
然而,Irving團隊遇到了一個意想不到的問題。他們設計的T細胞分泌的CV1包括一個Fc尾部,Fc尾部通常位于抗體分子的尾端,是吸引巨噬細胞攻擊的標簽。由于該標簽如今包覆在分泌工程化CV1的T細胞上,這招致了巨噬細胞對這些治療性T細胞的全面攻擊,導致遞送到小鼠體內的T細胞耗竭。
為了改變這種情況,論文第一作者、Irving團隊博士生Evangelos Stefanidis改造了T細胞,使其只表達沒有Fc尾部的CV1。這樣,改造后的T細胞就不會遭受人類巨噬細胞的靶向攻擊。
此外,將這些能產生CV1的T細胞與阿維魯單抗(avelumab)和西妥昔單抗(cetuximab)等癌癥靶向抗體結合,還能進一步提高巨噬細胞吞噬腫瘤細胞的能力。這是因為這些抗體,分別靶向免疫抑制性PD-L1分子和促進生長的表皮生長因子受體(EGFR)——具有活性Fc尾部,能吸引巨噬細胞特異性地攻擊腫瘤細胞。Irving團隊還觀察到,用這些抗體治療小鼠能有效改變腫瘤微環境,支持免疫攻擊。
Irving解釋說:“通過移除Fc尾部,我們可以使T細胞免受人類巨噬細胞的攻擊,而通過將這些經過改造的T細胞與含有活性Fc尾部的臨床抗體結合,我們可以有針對性地增強巨噬細胞對腫瘤細胞的吞噬作用。”
這些發現可能還有助于解釋為什么抗體藥物莫洛利單抗(magrolimab)的臨床試驗面臨重大挑戰,包括患者反應不佳和感染。與CV1誘餌一樣,莫洛利單抗也能阻斷腫瘤細胞表面上的CD47“別吃我”信號,從而促進免疫系統摧毀腫瘤細胞。但是,如果像帶有Fc尾部的CV1誘餌一樣,它的阻斷作用并不完全針對癌細胞,那么它可能會引起健康組織的破壞。
Irving說:“莫洛利單抗也有可能靶向包括T細胞在內的免疫細胞,使之受到吞噬。我們的聯合治療策略有助于引導專門針對腫瘤細胞的吞噬作用,同時保護我們的經過改造的T細胞。我們的研究結果還凸顯了癌癥治療的復雜性,以及采用細致入微的免疫療法的重要性。”