
2023年全球基因藥物臨床試驗注冊超過70個,顯示這一賽道正日益受到青睞。
日前,沙利文發布《基因藥物行業現狀與發展趨勢藍皮書》(下稱《藍皮書》)預測,基于我國龐大的慢性病、腫瘤患者人群,作為創新療法的基因藥物可以通過對致病基因進行干預,恢復其正常表達水平,有望實現“一次治療,終身治愈”。
《藍皮書》稱,截至2023年11月,全球共有12款基因藥物獲批上市,治療領域覆蓋腫瘤、血液系統疾病、神經系統疾病、眼科等。ClinicalTrials臨床試驗數據庫的檢索結果顯示,2018年起,基因藥物賽道熱度提升,每年有超40個臨床試驗注冊,并于2023年超過70個。
基因治療,指通過修改或控制基因的表達來達到治療疾病的目的,這涉及遺傳物質的轉錄、翻譯等;按類型可分為基因藥物、基因修飾細胞、溶瘤病毒等。
關于基因藥物研發,《藍皮書》提出6大核心要素,包括:遞送系統的安全性、基因編輯的安全性、基因表達調控、精準靶向病灶、規模化生產和產品質量控制。
對于基因藥物的現存挑戰,多位業內人士認為,價格昂貴是最大難題。其他挑戰則包括基因藥物的脫靶、編輯效率、CMC(化學成分生產與控制)成本、可及性等。
本導基因創始人蔡宇伽稱,基因藥物的價格昂貴會直接限制其臨床推廣和使用,“除了罕見病領域,基因藥物要拓展諸如神經系統疾病、實體瘤、重大病毒感染性疾病(乙肝、皰疹等感染)等領域。”
天澤云泰臨床前和轉化研究負責人朱晰表示,基因藥物價格昂貴在于其研發成本無法分攤,“研發人員需要為基因藥物找到更多適應證,來分攤研發成本,但基因藥物作為一種創新技術路線,其供應鏈(包括載體填料、培養基等)的不足需要時間去完善。”
面對上述挑戰,基因藥物企業該如何做?《藍皮書》撰寫團隊負責人、沙利文大中華區生命科學事業部咨詢總監李謙告訴記者,一方面,隨著研究深入,基因藥物正逐漸向其它疾病擴展適應證;另一方面,病毒載體的進一步優化將使得基因藥物的遞送系統向著高效、安全、低免疫原性的方向發展。此外,多元化支付模式也可以促使基因藥物在支付端更具有商業化能力。
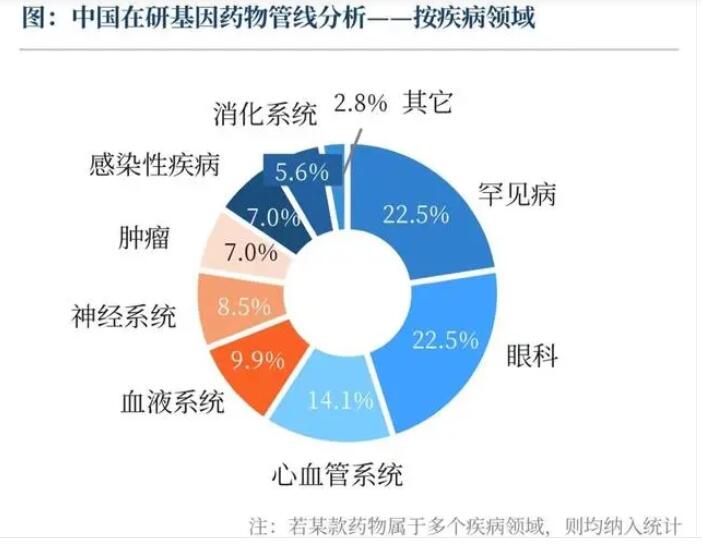
(圖為中國在研基因藥物管線分析-按疾病領域,來源《藍皮書》)
我國基因藥物企業的競爭格局如何?李謙表示,截至2023年10月31日,我國基因藥物在研管線主要布局在罕見病和眼科領域,兩者占比相當,均為22.5%;而研發階段上,則主要集中在臨床I期、I/II期的早期階段,少數管線進入了III期臨床。
“盡管我國已有數款基因修飾細胞產品獲批,但沒有基因編輯藥物上市,多家公司仍在布局BE(單堿基編輯)、PE(先導編輯)等技術。未來,我國有望迎來基因編輯藥物獲批上市。”李謙介紹道。