
6月10日,David Baker團隊在國際頂尖學術期刊Cell上發表了題為“Modulation of FGF pathway signaling and vascular differentiation using designed oligomeric assemblies”的研究論文。該研究通過從頭設計的環形蛋白質來調控成纖維細胞生長因子(FGF)信號通路和血管分化, 這種全新設計的蛋白質能夠指導人類干細胞形成新血管,這種對干細胞發育的調控是朝著更有效的再生醫學邁出的重要一步。

細胞表面受體聚集(Clustering)可以增強和維持對外源性信號的激活反應,因此人們對于調控受體聚集的技術頗感興趣。此前曾利用天然存在的受體結合域來驅動受體聚集,并使用幾何可調的二聚體配體來探究二聚化幾何結構對信號輸出的影響。更高階的受體復合物被認為在多種信號傳導系統中發揮作用;一個呈現受體結合域的可調節寡聚物支架將有助于研究納米級拓撲結構對受體輸出的影響。之前的設計工作產生了具有各種環形對稱性的寡聚體,但這些蛋白質不易進行修改以產生不同的受體結合構象。
成纖維細胞生長因子受體(FGFR)是一種酪氨酸激酶,在胚胎發育和癌癥中發揮著關鍵作用。該通路復雜且高度受調控,有四個FGFR基,以及兩種由外顯子8與外顯子9的選擇性剪接產生的異構體,這種選擇性剪接改變了第三個免疫球蛋白樣結構域(D3),生成了FGFR異構體IIIb和IIIc(簡稱b-異構體和c-異構體)。雖然D3是FGF結合區域的一部分,并且FGFR異構體對各種FGF配體的親和力不同,但兩種異構體對正常組織分化的貢獻尚未完全闡明。c-異構體在許多實體瘤中發生擴增,因此可能是癌癥治療的靶點。
在這項最新研究中,研究團隊描述了對幾何可調的環狀寡聚體的全新的從頭設計,以克服當前支架系統存在的局限性,并使用這些合成支架與針對FGFR的c-異構體設計的特異性迷你結合劑一起,探究并操控血管分化。
為了系統地探索受體親和力和幾何結構對信號傳遞結果的影響,研究團隊設計了使用可模塊化擴展的重復蛋白構建塊的環形同源寡聚體,其中包含多達8個亞基。通過將全新設計的成纖維細胞生長因子受體(FGFR)結合模塊整合到這些寡聚體支架中,研究團隊生成了一系列具有強大的親和力和幾何結構依賴性鈣離子釋放和MAPK通路激活的合成信號轉導配體。
這些設計的激動劑的高特異性揭示了兩種FGFR異構體(b-異構體、c-異構體)在早期血管發育期間驅動動脈內皮細胞和血管周圍細胞命運中的不同作用。該研究設計的模塊化組裝體在揭示關鍵發育過渡中的復雜信號傳遞機制以及開發未來治療應用方面具有廣泛的用途。
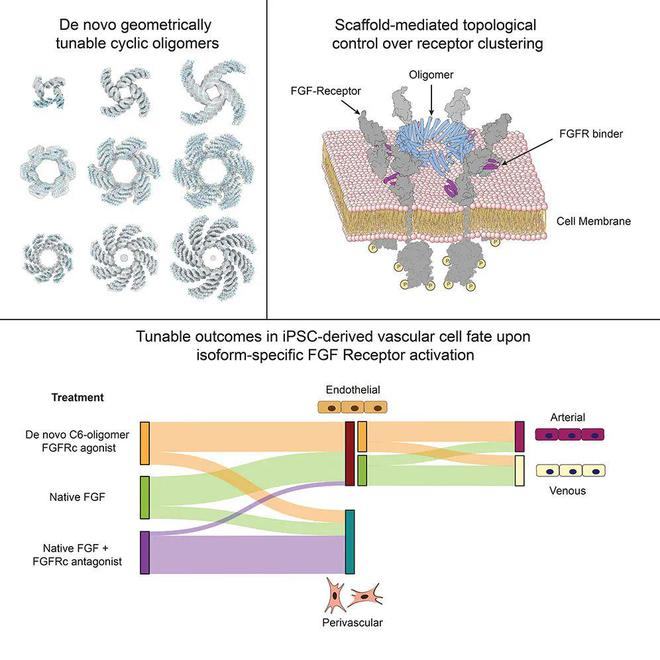
通俗來說,該研究從頭設計了一類全新的環形蛋白質,能夠靶向結合多達8個成纖維細胞生長因子受體(FGFR),通過改變環的大小和其他蛋白質的性質,可以控制干細胞在實驗室條件下的成熟,能夠形成功能性的和成熟的血管網,這些血管網可進一步形成管狀結構,還能在劃傷后愈合,并像預期的那樣從周圍環境中吸收養分。當移植到小鼠體內后,這些小型人體血管網在三周內就與小鼠循環系統建立了聯系。
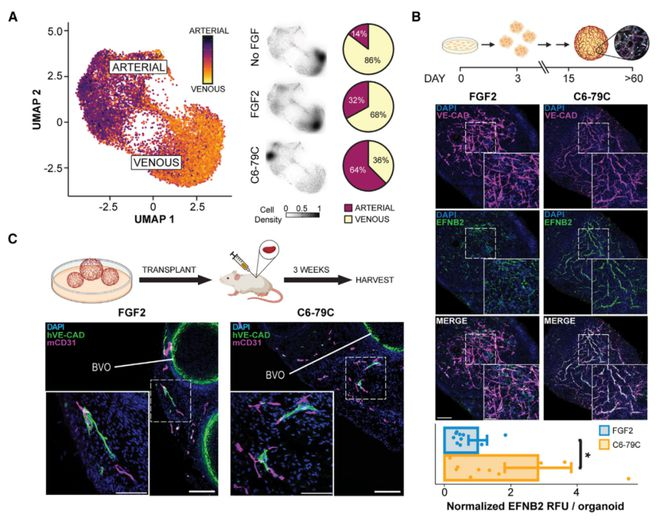
研究團隊表示,該研究首次使用從頭設計的蛋白質來指導干細胞成為形成動脈壁的內皮細胞,這一突破將幫助研究人員模擬相關疾病并再生血管。這項研究首先聚焦于構建血管網,但該技術還適用于許多其他類型的組織。這為研究組織發育開辟了一種新途徑,并可能為脊髓損傷等目前沒有好的治療選擇的疾病帶來全新的治療藥物。