
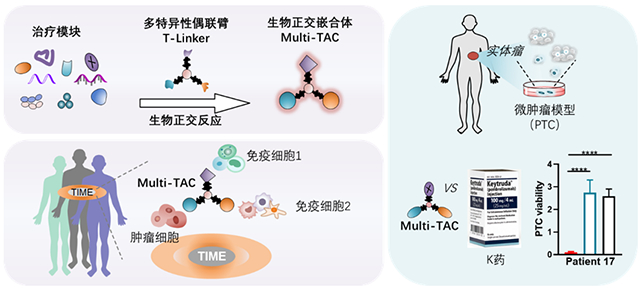
圖 “多細胞招募”的生物正交嵌合體靶向實體瘤免疫微環境
在國家自然科學基金項目(批準號:21432002、21521003、T2288102、82150005、32122035、82274034)資助下,北京大學陳鵬教授與本校席建忠教授、中國醫學科學院腫瘤醫院康曉征教授、南京大學李顏教授和北京大學第三醫院林堅研究員合作,開發了一種“多細胞招募”的生物正交嵌合體,靶向實體瘤免疫微環境。相關成果以“多特異性嵌合體用于腫瘤免疫微環境靶向的整合免疫療法”(Multimodal targeting chimeras enable integrated immunotherapy leveraging tumor-immune microenvironment)為題,于2024年11月5日在《細胞》(Cell)上發表。
免疫療法為癌癥治療帶來了革命性改變,大部分免疫療法在血液瘤中效果顯著,然而在實體瘤中響應率低、治療效果差。其主要原因在于實體瘤存在復雜且高度異質的腫瘤免疫微環境,多種類型免疫細胞協同影響免疫治療效果。理想條件下,開發出能同時調動多種免疫細胞的治療策略,將極大提高實體瘤治療效果。然而傳統免疫療法,如免疫檢查點抑制劑、過繼性細胞療法、雙/多特異性抗體等,大多只針對單一類型的免疫細胞發揮作用。因此,亟需開發一種方法能夠同時招募多種免疫細胞對抗腫瘤。
針對以上問題,該團隊開發了一種高度模塊化的生物正交嵌合體平臺,該平臺利用其發展的多特異生物正交偶聯臂(T-Linker)精準整合多種藥物分子,從而構建各種類型的多特異性生物正交嵌合體(Multi-TAC),用于同時招募T細胞、樹突狀細胞(DC)、自然殺傷細胞(NK)以及髓系免疫細胞等,靶向實體瘤免疫微環境。該團隊系統地研究了EGFR-CD3-PDL1 Multi-TAC嵌合體,其通過介導“腫瘤細胞-T細胞-DC”三者的直接相互作用,同時激活了腫瘤組織中T細胞和DC,逆轉腫瘤免疫微環境,誘導腫瘤特異性免疫響應,最終顯著提高了實體瘤免疫治療效果。該研究為腫瘤免疫治療提供了一種全新的思路。