
近日,西北大學聯合空軍軍醫大學研究團隊制備了一種基因工程重組細胞外囊泡PSMAscFv-EVN-GSDMD,其表面表達對前列腺特異性膜抗原(PSMA)具有高親和力的單鏈可變抗體片段(scFv),并負載有gasderminD(GSDMD)的N-末端結構域。相關研究成果發表在Biomaterials上。
前列腺癌(PCa)與免疫原性差和淋巴細胞浸潤有關,目前仍缺乏有效的免疫療法。焦亡是一種新型癌癥免疫治療方式,可促進全身免疫反應,誘導實體瘤中的免疫原性細胞死亡。近期研究表明,通過多種途徑直接遞送N-GSDMD來誘導焦亡,可以有效治療不同的疾病。因此,通過直接將N-GSDMD遞送至腫瘤細胞來逆轉免疫抑制性腫瘤微環境具有廣闊的應用前景,但如何將N-GSDMD遞送到腫瘤細胞是目前面臨的巨大挑戰。
人胚胎腎(HEK)293T細胞系表現出良好的生物學特性,如高轉染效率和易于培養,常用于細胞生物學和生物技術實驗。來源于HEK293T細胞的細胞外囊泡(EV)具有高穩定性、可及性和豐度,在疾病治療中應用潛力巨大。“EVs”是由脂雙層界定的細胞自然釋放的非復制顆粒,根據大小和形態,可分為不同類別的分泌性囊泡。生物體液中直徑為50至150nm的小型EV最豐富,參與細胞間通訊、免疫、發育、神經生物學和微生物學等各種生理過程。盡管還處于起步階段,但由于其低毒性、免疫原性以及高工程化,小型EVs有望成為藥物遞送的載體。EVs已用于各種疾病模型的靶向治療,如抗表皮生長因子受體單鏈可變片段(scFv)功能化的外泌體可以遞送溶血磷脂酰膽堿酰基轉移酶特異性siRNAs,抑制肺癌腦轉移。此外, GelMA/納米粘土水凝膠負載的人臍帶間充質干細胞衍生小EVs可以促進軟骨再生。因此,作者假設具有特異性遞送能力的含N-GSDMD細胞外囊泡將是一種有效的抗PCa治療策略。
以EV為基礎的基因治療有望用于前列腺癌的治療。該研究設計了一種表達溶酶體相關膜糖蛋白2b基因(Lamp2b)的慢病毒載體,含有前列腺特異性膜抗原(PSMA)特異性scFv,并將其轉染到HEK-293T細胞中以得到一種新型細胞外囊泡PSMAscFv-EV。隨后,PSMAscFv-EV負載N-GSDMD,得到基于HEK-293TEV的多功能靶向遞送平臺PSMAscFv-EVN-GSDMD。研究認為該平臺可以靶向PSMA受體,并在沒有蛋白酶切割的情況下直接觸發PSMA陽性PCa細胞焦亡。體外和體內結果表明,PSMAscFv-EVN-GSDMD可以特異性靶向PSMA陽性PCa細胞,抑制腫瘤生長并激活抗腫瘤免疫反應。該研究制備了PSMAscFv-EVN-GSDMD,驗證了靜脈注射PSMAscFv-EVN-GSDMD靶向和治療表達PSMA的前列腺癌的可行性,為前列腺癌免疫療法提供了新參考。
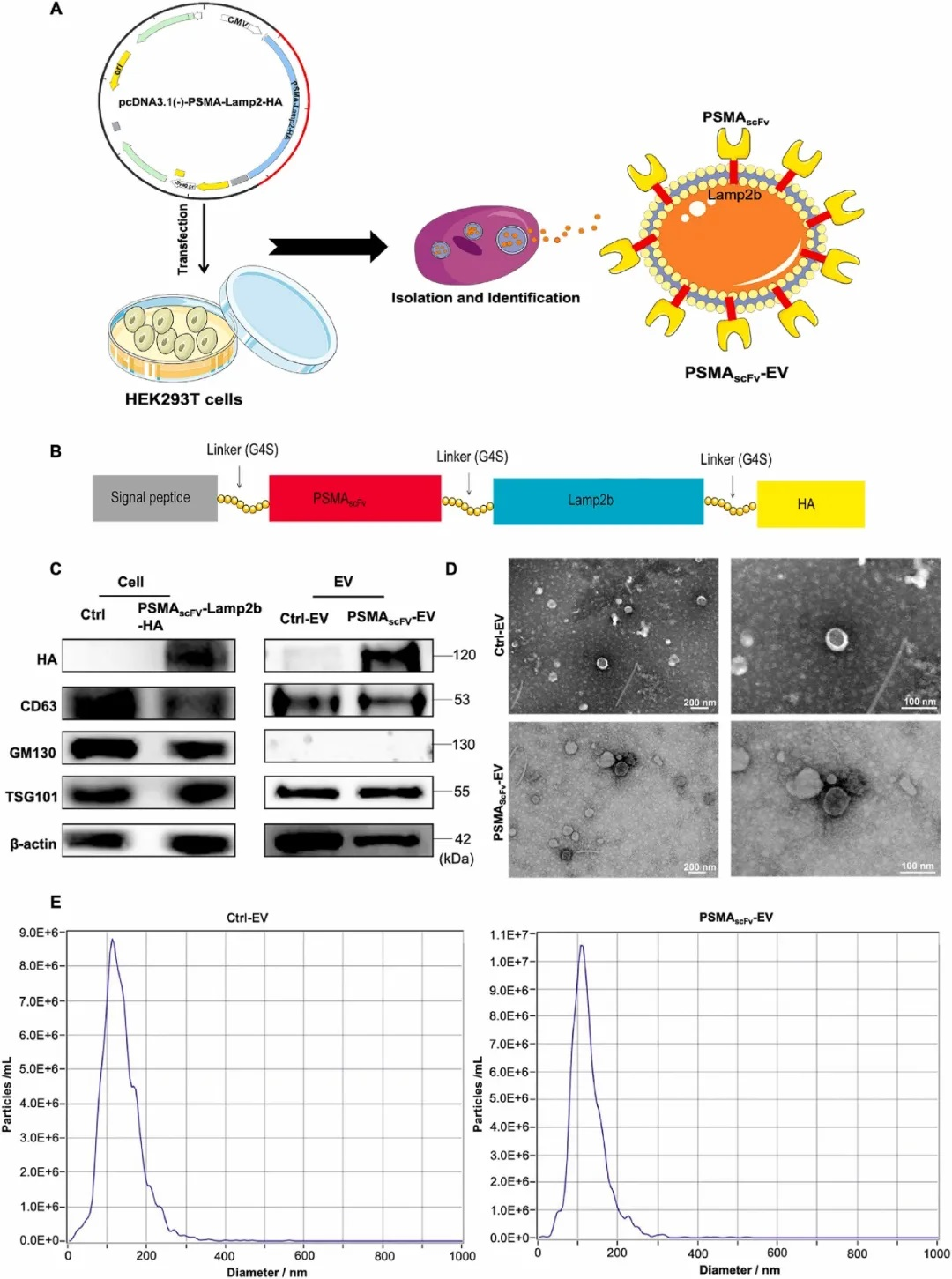
PSMAscFv-EVN-GSDMD的制備和表征。(課題組供圖)
相關論文信息:https://doi.org/10.1016/j.biomaterials.2024.122894