
近日,延世大學醫學院的研究人員在Cell Stem Cell期刊發布了題為Preclinical and dose-ranging assessment of hESC-derived dopaminergic progenitors for a clinical trial on Parkinson's disease的研究論文。
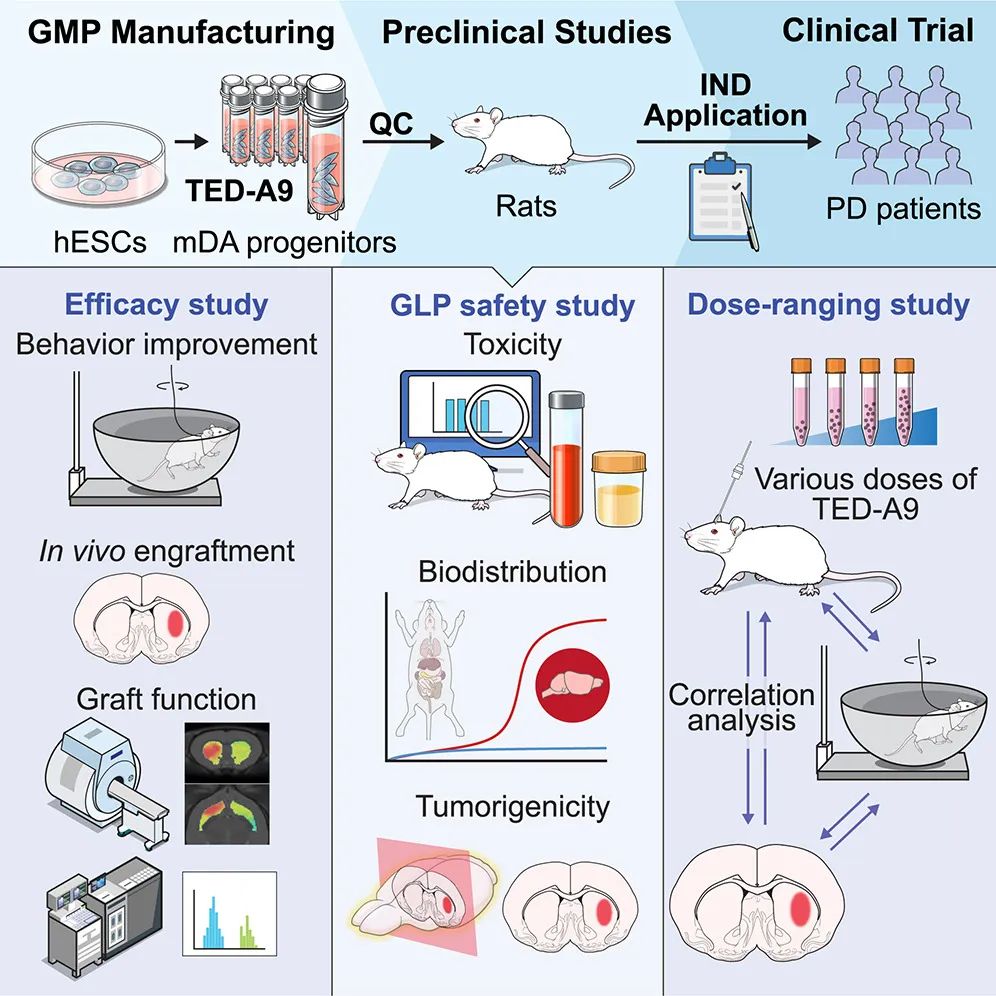
該研究從臨床級人胚胎干細胞(hESC)中大規模生成高純度的中腦多巴胺能(mDA)祖細胞,并在體外和體內驗證了mDA祖細胞的安全性和有效性。mDA祖細胞以移植劑量依賴性地改善了帕金森病大鼠模型的疾病相關行為。基于這些這些臨床前研究結果,研究團隊獲得了韓國食品和藥物安全部批準進行帕金森病細胞療法的1/2a期臨床試驗,并開始了對12名帕金森病患者的治療。
2020年5月,麻省總醫院的研究人員在《新英格蘭醫學雜志》(NEJM)報告了一項開創性研究,一名接受自體移植hiPSC來源的mDA祖細胞的帕金森病患者,在植入后24個月時表現出臨床癥狀穩定或改善。現在,這種方法得到了進一步的發展,hiPSC來源的hESC來源的mDA祖細胞開始進入到早期臨床試驗階段。
將細胞移植用于帕金森病的臨床應用的第一步是全面定義細胞產品特征。確定細胞是否在GMP條件下使用臨床級材料生產,以及它們是否符合預期的臨床使用標準至關重要。隨后,臨床前研究應該通過大規模動物實驗產生令人信服的療效證據,并系統地檢查長期安全性相關問題,如毒性、生物分布和致瘤性。此外,臨床前研究需要確定移植的最佳細胞劑量范圍,作為人類試驗的參考。最重要的是,整個研究設計必須細致,結果必須以公正的方式評估。這通常需要與CRO公司合作,并與監管機構進行廣泛討論。
該論文描述了一項臨床前研究的過程和結果,旨在將人胚胎干細胞(hESC)來源的中腦多巴胺能(mDA)神經元用于治療帕金森病的人體臨床試驗。
該研究使用的細胞分化方法已經得到優化,以便臨床應用,確保符合GMP標準。這種優化方法能夠大規模生產高純度、低溫可保存的mDA祖細胞,同時保持嚴格的質量控制。由獨立CRO公司使用免疫缺陷大鼠進行的長達一年的大規模移植研究表明,移植的mDA神經元沒有導致致瘤性、顯著毒性或注射部位外的異位整合。此外,臨床mDA前體細胞顯示出治療潛力和劑量范圍,在毒素誘導的半帕金森大鼠中產生了治療效果。這些發現提供了有關人體試驗適當細胞劑量的必要信息。
具體來說,該論文介紹了在嚴格的GMP條件下從臨床級hESC中大規模提取高純度mDA祖細胞的方法,還在符合良好實驗室規范(GLP)的設施中評估了這些細胞在免疫缺陷大鼠中的毒性、生物分布和致瘤性。將不同劑量的mDA祖細胞移植到半帕金森大鼠模型中,觀察到在最小有效劑量范圍為5000-10000個mDA祖細胞時,出現了顯著的劑量依賴性的行為改善。這些結果為確定人類臨床試驗的低細胞劑量(315萬個細胞 )提供了依據。
基于這些實驗結果,研究團隊獲得了韓國食品和藥物安全部批準進行帕金森病細胞療法的1/2a期臨床試驗,并開始了治療帕金森病患者的臨床試驗。